CAMBRIA-1-Studie
THERAPIESTUDIE ZUR BEWERTUNG DER WIRKSAMKEIT UND SICHERHEIT VON CAMIZESTRANT IN DER BEHANDLUNG VON PATIENT:INNEN MIT ER-POSITIVEM, HER2-NEGATIVEM FRÜHEM BRUSTKREBS
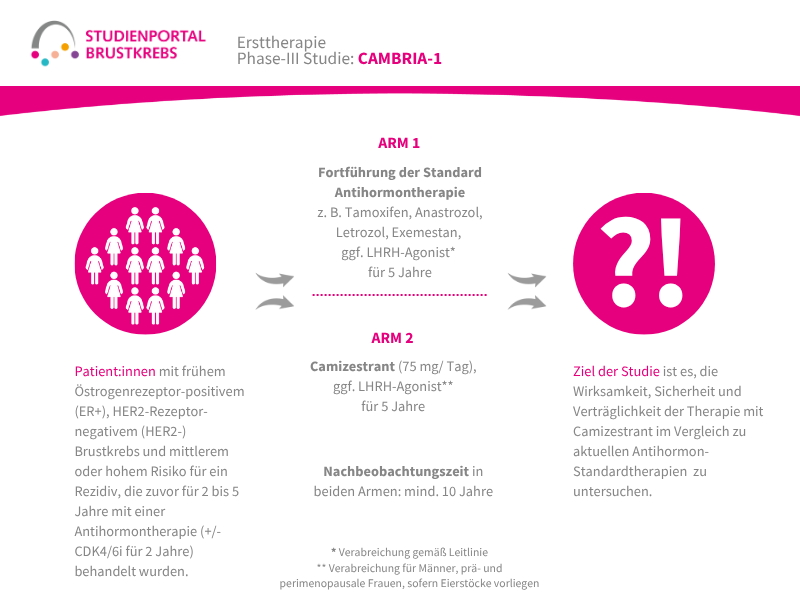
Die CAMBRIA-1 ist eine offene (behandelnde Ärzt:innen und Patient:innen kennen den zugeordneten Behandlungsarm), randomisierte (zufällige Zuteilung in einen Behandlungsarm) Phase-3-Studie zur Bewertung der Wirksamkeit und Sicherheit des Medikaments Camizestrant als verlängerte Antihormontherapie im Vergleich zur Standard-Antihormontherapie bei Patient:innen mit frühem Brustkrebs, welcher Östrogenrezeptoren aufweist (ER+), aber keine humanen epidermalen Wachstumsfaktor-Rezeptoren 2 (HER2-) und die ein mittleres oder hohes Risiko für einen Krankheitsrückfall (Rezidiv) aufweisen. Die Patient:innen müssen bereits die Operation abgeschlossen und danach mit einer Antihormontherapie begonnen haben (für mind. 2 bis max. 5 Jahre) mit oder ohne Cyclin-abhängigem Kinase-4- und -6(CDK4/6)-Inhibitor, unter der die Krankheit nicht fortgeschritten ist.
Was wird in dieser Studie untersucht?
Camizestrant ist ein orales Medikament (Tablette) der nächsten Generation, das Östrogenrezeptoren in Brustkrebszellen zerstört (Östrogen Degrader). Tumore mit Hormonrezeptoren können durch natürlich im Körper vorkommende Hormone (z. B. Östrogen) Wachstumssignale bekommen. Camizestrant soll diese Signalübertragung stören und somit das Tumorwachstum stoppen. In vorangegangenen Studien war dieses Medikament bereits gegen Brustkrebs wirksam (z. B. SERENA-1).
Was ist das Ziel der Studie?
Das primäre Ziel der Studie ist es, die Wirksamkeit, Sicherheit und Verträglichkeit der Therapie mit Camizestrant zu vergleichen mit der aktuellen Standard-Antihormontherapie (Aromatasehemmer oder Tamoxifen) bei Patient:innen mit einem HER2-negativem, ER-positivem Brustkrebs im Frühstadium. Primär wird die Zeit, in der die Krankheit nicht fortschreitet (Auftreten eines Rezidivs oder einer Fernmetastase) gemessen. Zudem werden auch die Gesamtüberlebenszeit und die Verträglichkeit der Therapie untersucht.
Wie ist der Ablauf der Studie?
Patient:innen, die an der Studie teilnehmen können, werden im Verhältnis 1:1 zufällig einem der zwei Behandlungsarme zugeordnet und erhalten:
Arm 1 (Kontrollgruppe)
Fortführung der Standard-Antihormontherapie (mögliche Therapien: Tamoxifen oder Aromataseinhibitoren (Anastrozol, Letrozol, Exemestan) ( +/- LHRH-Agonisten*) für weitere 5 Jahre
oder
Arm 2
Camizestrant 75 mg ( +/- LHRH-Agonisten*) für weitere 5 Jahre
* prä- und perimenopausale Frauen sowie Männer erhalten einen LHRH (Frauen obligatorisch in beiden Armen, sofern die Eierstöcke noch vorliegen, bei Männern nur mit Aromataseinhibitoren)
Die Nachbeobachtungszeit für beide Arme beträgt mindestens 10 Jahre.
Gibt es Risiken?
Über mögliche Risiken bzw. Nebenwirkungen, die mit der Teilnahme verbunden sind, werden Sie im Rahmen eines Aufklärungsgesprächs informiert.
Teilnahmevoraussetzungen
An dieser Studie können Frauen und Männer ab einem Alter von 18 Jahre teilnehmen, mit:
- ER+, HER2− Brustkrebs im Frühstadium
- Einem mittleren oder hohem Risiko für ein Rezidiv
- Vollständig abgeschlossener Operation
- Mindestens 2 bis maximal 5 Jahren Antihormontherapie (nach Operation)
- Ohne Hinweise auf ein Rezidiv
- Planung einer weiteren Behandlung mit Antihormontherapie für 5 Jahre
Darüber hinaus gibt es aber auch noch weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patient:innen sollten mit den Prüfärzt:innen an einem Studienzentrum sprechen, welche prüfen können, ob diese Studie für Sie in Frage kommt.
Wo kann ich an dieser Studie teilnehmen?
Weitere Informationen zu teilnehmende Zentren finden Sie hier:
https://studienportal-brustkrebs.de/deutschlandkarte
Diese Studie wird unterstützt von: