EvoPAR-Breast01-Studie
STUDIE ZUR BEWERTUNG DER WIRKSAMKEIT UND SICHERHEIT EINER KOMBINATIONSTHERAPIE MIT SARUPARIB UND CAMIZESTRANT IN DER BEHANDLUNG VON PATIENT:INNEN MIT HER2-NEGATIVEM, ER-POSITIVEM, FORTGESCHRITTENEM BRUSTKREBS
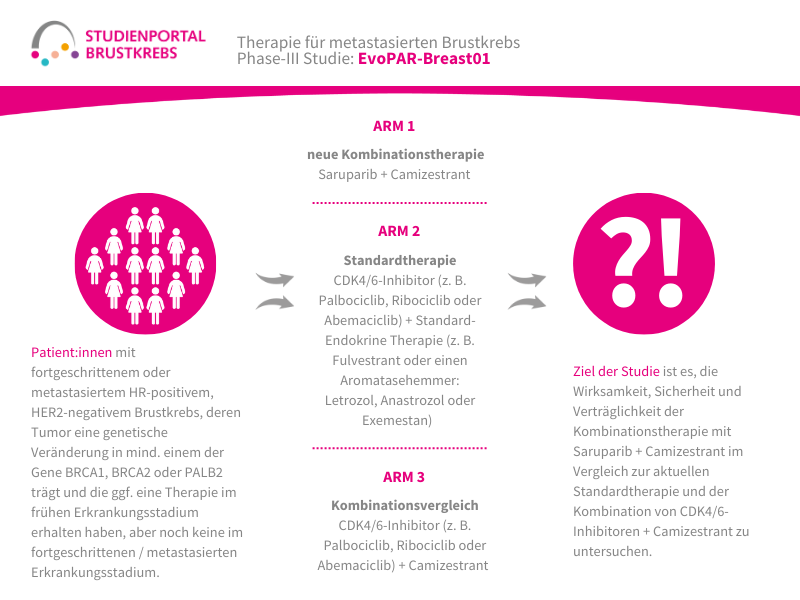
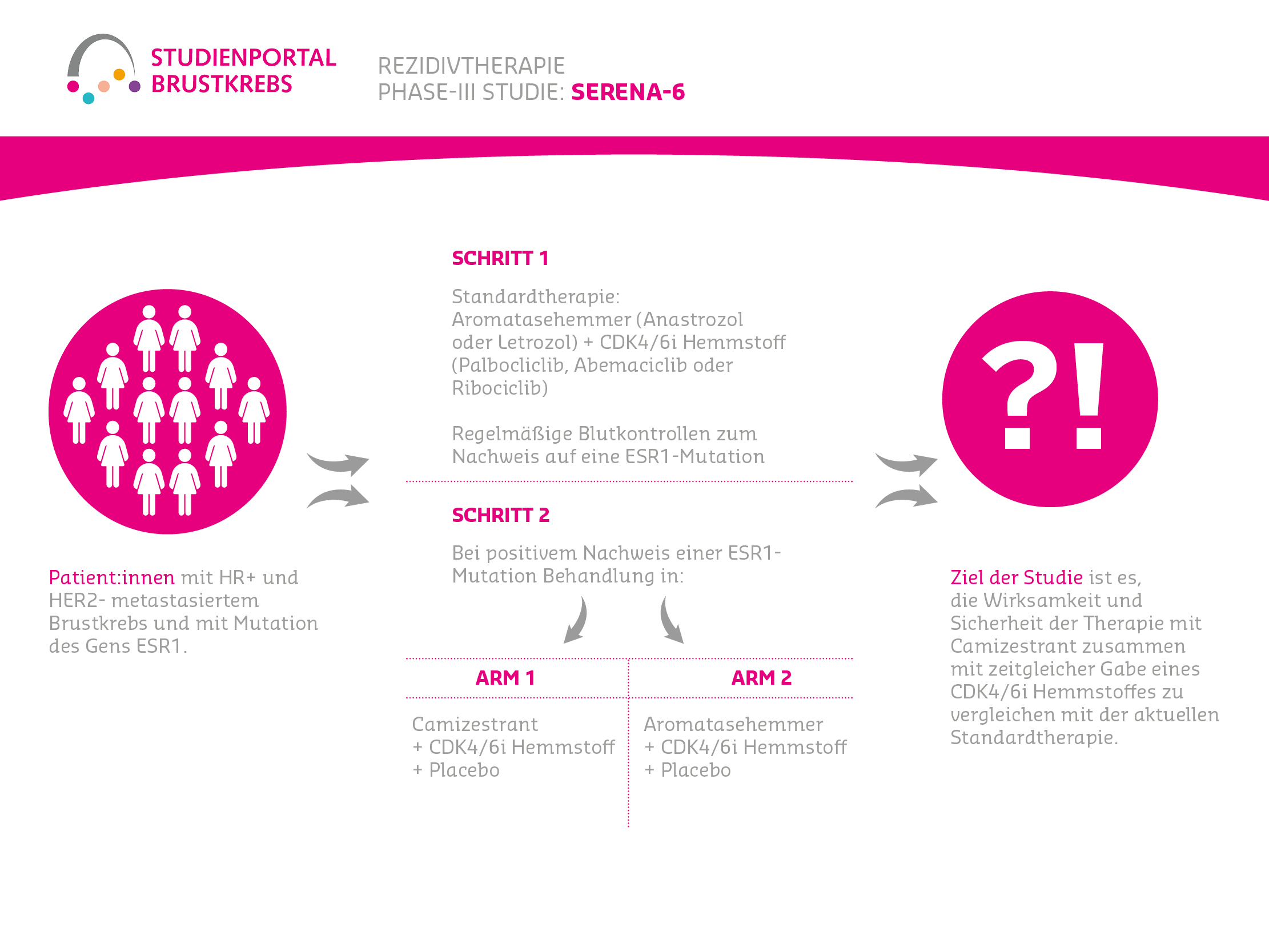
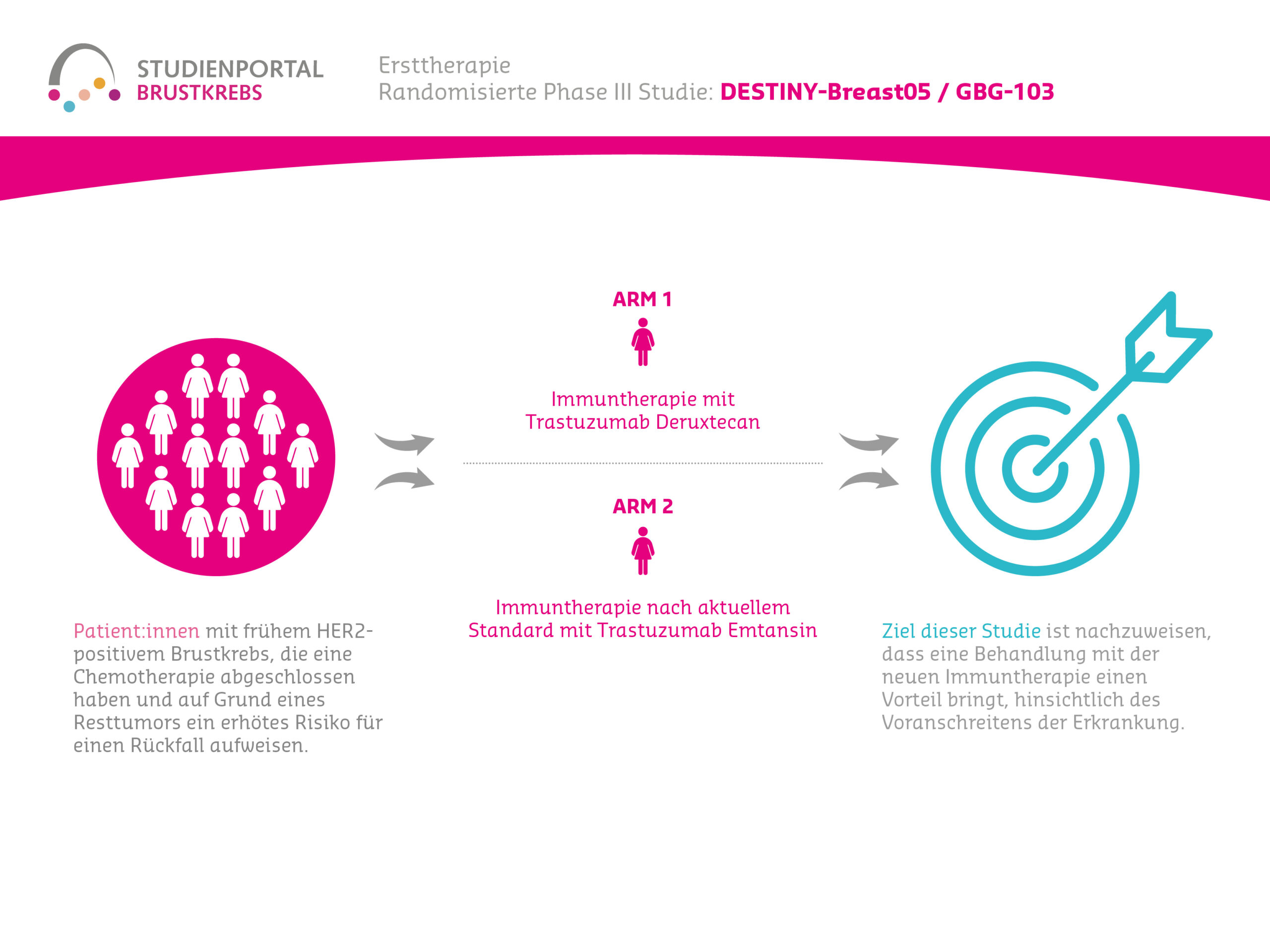
Die EvoPAR-Breast01 ist eine offene (Behandelnde und Patient:innen wissen, welche Therapie verabreicht wird), randomisierte Phase-III-Studie. In der Studie wird eine neue Kombinationstherapie aus Saruparib und Camizestrant mit der bisherigen Standardtherapie verglichen. Die Studie richtet sich an Patient:innen mit metastasiertem oder lokal fortgeschrittenem, hormonrezeptor-positivem, HER2-negativem Brustkrebs, die eine bestimmte genetische Veränderung (BRCA1-, BRCA2- oder PALB2-Mutation) in ihren Krebszellen tragen. Für das frühe Erkrankungsstadium (Adjuvanz) durften die Patientinnen unter bestimmten Voraussetzungen bereits Therapien erhalten haben, aber noch nicht für das fortgeschrittene bzw. metastasierte Stadium (siehe Teilnahmebedingungen).
Was wird in dieser Studie untersucht?
Bei etwa 70 % aller Brustkrebserkrankungen handelt es sich um Hormonrezeptor-positiven (HR+) und HER2-negativen Brustkrebs. Viele dieser Tumore wachsen durch das Hormon Östrogen. Aktuelle Standardtherapien bei fortgeschrittenem Brustkrebs kombinieren eine endokrine Therapie (also eine Antihormontherapie) mit einem Medikament, das bestimmte Wachstumssignale in den Tumorzellen blockiert – sogenannte CDK4/6-Inhibitoren.
Die EvoPAR-Breast01-Studie richtet sich speziell an Patient:innen, bei denen im Tumor eine genetische Veränderung (Mutation) im BRCA1-, BRCA2- oder PALB2-Gen nachgewiesen wurde. Diese Gene sind normalerweise dafür zuständig, Schäden an der DNA zu reparieren. Ist ihre Funktion gestört (auch „Loss of Function“ genannt), kann das zur Entstehung und zum Wachstum von Krebszellen beitragen.
Saruparib gehört zu der Medikamentenklasse der PARP-Inhibitoren, welche gezielt Krebszellen mit DNA-Reparaturdefekten (z. B. durch BRCA-Mutationen) angreifen und zum Absterben bringen können.
Camizestrant ist ein sogenannter Estrogen-Rezeptor-Degrader, ein modernes Medikament, das den Östrogenrezeptor auf Krebszellen zerstört und so das Tumorwachstum bremsen kann.
Was ist das Ziel der Studie?
Hauptziel der Studie ist es zu untersuchen, wie lange der Krebs unter der jeweiligen Behandlung nicht weiter wächst – auch progressionsfreies Überleben (PFS) genannt. Die Untersuchung erfolgt dabei durch ein unabhängiges Expertenteam mittels bildgebender Verfahren (z. B. CT, MRT). Außerdem wird die gesamte Überlebenszeit, sowie die Zeit bis zum zweiten Progress, die Zeit bis zur Verabreichung der nächsten Chemotherapie und weitere wichtige Fragestellungen beobachtet.
Wie ist der Ablauf der Studie?
An der Studie nehmen etwa 500 Patient:innen teil. Sie werden nach dem Zufallsprinzip in drei Gruppen, sogenannte Behandlungsarme, aufgeteilt (randomisiert im Verhältnis 2:2:1):
- Arm 1 (neue Kombinationstherapie)
Saruparib + Camizestrant - Arm 2 (Standardtherapie)
CDK4/6-Inhibitor (z. B. Palbociclib, Ribociclib oder Abemaciclib) + Standard-Endokrine Therapie (z. B. Fulvestrant oder einen Aromatasehemmer: Letrozol, Anastrozol oder Exemestan) - Arm 3 (Kombinationsvergleich)
CDK4/6-Inhibitor (z. B. Palbociclib, Ribociclib oder Abemaciclib) + Camizestrant
Alle Medikamente werden entweder als Tablette oder Infusion verabreicht, abhängig vom jeweiligen Studienarm. Die Gabe der jeweiligen Therapie erfolgt in jedem Studienarm bis zum Voranschreiten der Erkrankung.
Die Patient:innen werden regelmäßig während der Studie und bis zu 30 Tage nach der letzten Medikamenteneinnahme beobachtet, um die Wirksamkeit und Verträglichkeit der Therapien zu erfassen. Auch danach erkundigen sich die Behandler:innen etwa alle 12 Wochen über den Zustand der Patient:in, bis die Studie offiziell abgeschlossen ist.
Gibt es Risiken?
Über mögliche Risiken bzw. Nebenwirkungen, die mit der Teilnahme verbunden sind, werden Sie im Rahmen eines Aufklärungsgesprächs informiert.
Teilnahmevoraussetzungen
An dieser Studie können Frauen und Männer ab einem Alter von 18 Jahren teilnehmen, mit:
- Metastasiertem Brustkrebs (mBC); dabei kann der Brustkrebs entweder:
(1) von Anfang an als metastasiert oder lokal fortgeschritten diagnostiziert worden sein oder
(2) der Brustkrebs kann zuvor in der Adjuvanz (= zusätzliche Behandlung nach der Operation, z. B. Chemotherpie oder Hormontherapie) mit dem Ziel auf Heilung therapiert worden sein.
– Falls eine Chemotherapie in der Adjuvanz gegeben wurde, muss diese jedoch mehr als 84 Tage her sein.
– Falls in der Adjuvanz PARP-Inhibitoren, CDK4/6-Inhibitoren oder orale SERDs gegeben wurden, müssen diese diese Therapien mehr als 365 Tage zurückliegen.
- Für die metastasierte Situation durfte noch keine Therapie (also Erstlinientherapie) gegeben worden sein
- Der Tumor muss HR-positiv, HER-2 negativ sein
- Der Tumor muss eine BRCA1- oder BRCA2- oder PALB2 Mutation aufweisen, die entweder in der Keimbahn (angeboren oder vererbbar) oder im Tumor (somatisch) nachgewiesen werden kann
Darüber hinaus gibt es aber auch noch weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patient:innen sollten mit den Prüfärzt:innen an einem Studienzentrum sprechen, ob diese Studie für Sie in Frage kommt.
Wo kann ich an dieser Studie teilnehmen?
Weitere Informationen zu teilnehmende Zentren finden Sie hier:
https://studienportal-brustkrebs.de/deutschlandkarte
Diese Studie wird unterstützt von: