SERENA-6-Studie
Therapiestudie zur Bewertung der potenziellen zusätzlichen Wirksamkeit und Sicherheit von Camizestrant in der Erstlinien-Behandlung von Patient:innen mit HER2-negativem, HR-positivem, ESR1-mutiertem Brustkrebs
Die Rekrutierung der Studie wurde Ende 2024 abgeschlossen.
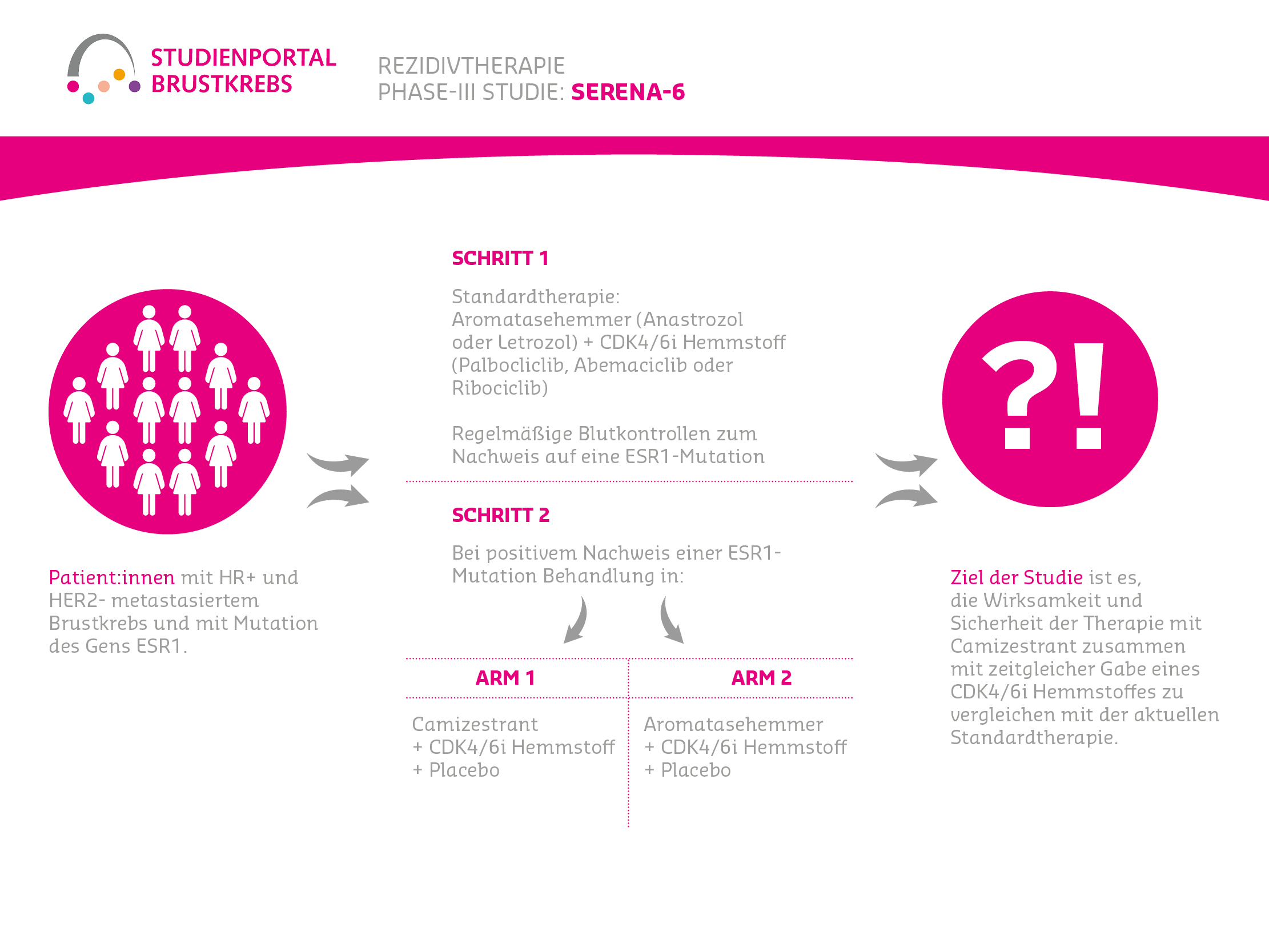
Die SERENA-6 ist eine doppelt-verblindete (weder Patient:in noch behandelnde Ärzte wissen den Behandlungsarm), randomisierte (zufällige Zuteilung in einen Behandlungsarm) Phase-3-Studie zur Bewertung der Wirksamkeit und Sicherheit des Medikaments Camizestrant im Vergleich zu Aromatasehemmern (Letrozol oder Anastrozol) in Kombination mit Palbociclib oder Abemaciclib oder Ribociclib bei Patient:innen mit metastasiertem Brustkrebs, welcher Hormonrezeptoren aufweist (HR+), aber keine humanen epidermalen Wachstumsfaktor-Rezeptoren-2 (HER2-). Der Krebs muss außerdem nachweisbar eine Mutation in einem bestimmten Gen aufweisen (ESR1m) und die Krankheit darf unter der Erstlinientherapie nicht fortgeschritten sein.
Was wird in dieser Studie untersucht?
Hormonrezeptor-positive (HR+), humane epidermale Wachstumsfaktor-Rezeptor-2-negative (HER2-) Tumore machen nach aktuellem Stand mehr als zwei Drittel aller Brustkrebsfälle aus. Aktuelle Leitlinien empfehlen für diese Tumore eine kombinierte Behandlung mit einer endokrinen Therapie, z. B. mit einem Aromatasehemmer und einem Hemmstoff gegen bestimmte Proteine (Cyclin-abhängige Kinasen 4 und 6 (CDK4/6i)) als Erstlinien-Behandlung von metastasiertem (in andere Organe gestreuten) HR+/HER2- Brustkrebs. In vielen Fällen entwickelt sich allerdings mit der Zeit eine Medikamentenresistenz, die zu einem Fortschreiten der Krankheit führen kann. Tumore mit Mutationen im Östrogenrezeptor-alpha-Gen (ESR1m) sind bekannt dafür, eine Resistenz gegen Aromatasehemmer zu entwickeln und sie werden außerdem mit aggressiveren Krankheitsmerkmalen, einschließlich der Entwicklung viszeraler (Organe im Bauchbereich betreffend) Metastasen, in Verbindung gebracht. Demzufolge sind die erwarteten Behandlungsergebnisse nachfolgender Therapien bei Patient:innen mit ESR1m-positivem Brustkrebs relativ schlecht und es werden neue Ansätze benötigt, um die Behandlungsergebnisse zu verbessern und ein weiteres Fortschreiten der Krankheit zu verhindern.
Camizestrant ist ein orales (Tablette) Medikament der nächsten Generation, das Östrogenrezeptoren in Brustkrebszellen zerstört (Östrogen Degrader). Tumore mit Hormonrezeptoren können durch natürlich im Körper vorkommende Hormone (z. B. Östrogen) Wachstumssignale bekommen. Camizestrant soll diese Signalübertragung stören und somit das Tumorwachstum stoppen. In vorangegangenen Studien war dieses Medikament bereits gegen Mammakarzinom wirksam (z. B. SERENA-1).
Was ist das Ziel der Studie?
Das primäre Ziel der Studie ist es, die Wirksamkeit der Therapie mit Camizestrant zusammen mit zeitgleicher Gabe eines CDK4/6i Hemmstoffes zu vergleichen mit der aktuellen Standardtherapie bei Patient:innen mit einem HER2-negativem, HR-positivem, ESR1-mutierten Brustkrebs in der Erstlinien-Behandlung (erste Behandlung von erstmalig festgestellten Metastasen). Außerdem wird der Verlauf der Lebensqualität der Patient:innen mit Hilfe von Fragebögen erhoben.
Wie ist der Ablauf der Studie?
Schritt 1:
Brustkrebspatient:innen in der Erstlinie werden nach aktuellem Standard (Aromatasehemmer = Anastrozol oder Letrozol + CDK4/6i = Palbociclib, Abemaciclib oder Ribociclib) behandelt und regelmäßig (alle 2-3 Monate) auf eine ESR1-Mutation in den Krebszellen (durch Blutentnahmen) kontrolliert.
Schritt 2:
Patient:innen, deren Tumorzellen während einer dieser Kontrolluntersuchungen eine ESR1-Mutation aufweisen, werden im Verhältnis 1:1 zufällig einem der zwei Behandlungsarme zugeordnet und erhalten:
Arm A
Camizestrant + den zuvor bereits erhaltenen CDK4/6i Hemmstoff + ein Placebo als Ersatz für den Aromatasehemmer
oder
Arm B (Standardtherapie)
Den zuvor erhaltenen Aromatasehemmer + CDK4/6i Hemmstoff + ein Placebo als Ersatz für den Östrogenrezeptor-Degrader
Gibt es Risiken?
Über mögliche Risiken bzw. Nebenwirkungen, die mit der Teilnahme verbunden sind, werden Sie im Rahmen eines Aufklärungsgesprächs informiert.
Teilnahmevoraussetzungen
An dieser Studie können Männer und Frauen ab einem Alter von 18 Jahre teilnehmen, mit:
- Hormonrezeptor-positivem (HR+),
- HER2−negativem,
- lokal fortgeschrittenem (inoperablem) oder metastasierendem (gestreuten) Brustkrebs
- Aktuelle Behandlung mit einem Aromatasehemmer (Anastrozol oder Letrozol) + CDK4/6i (Palbociclib, Abemaciclib oder Ribociclib) in der Erstlinie
- ≥ 6 Monate ohne Anzeichen eines Krankheitsfortschritts
- Für die Behandlung in Schritt 2: Nachgewiesene ESR1 Mutation des Tumors
Darüber hinaus gibt es aber auch noch weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patient:innen sollten mit den Prüfärzt:innen an einem Studienzentrum sprechen, welche prüfen können, ob diese Studie für sie in Frage kommt.
Wo kann ich an dieser Studie teilnehmen?
Weitere Informationen zu teilnehmende Zentren finden Sie hier:
https://studienportal-brustkrebs.de/deutschlandkarte
Diese Studie wird unterstützt von: