GeparPiPPa / GBG-105
THERAPIESTUDIE ZUR BEWERTUNG DER POTENZIELLEN ZUSÄTZLICHEN WIRKSAMKEIT UND SICHERHEIT VON INAVOLISIB IN DER BEHANDLUNG VOR OPERATION VON PATIENT:INNEN MIT HER2-POSITIVEM, HR-POSITIVEM, PIK3CA-MUTIERTEM BRUSTKREBS IM FRÜHSTADIUM.
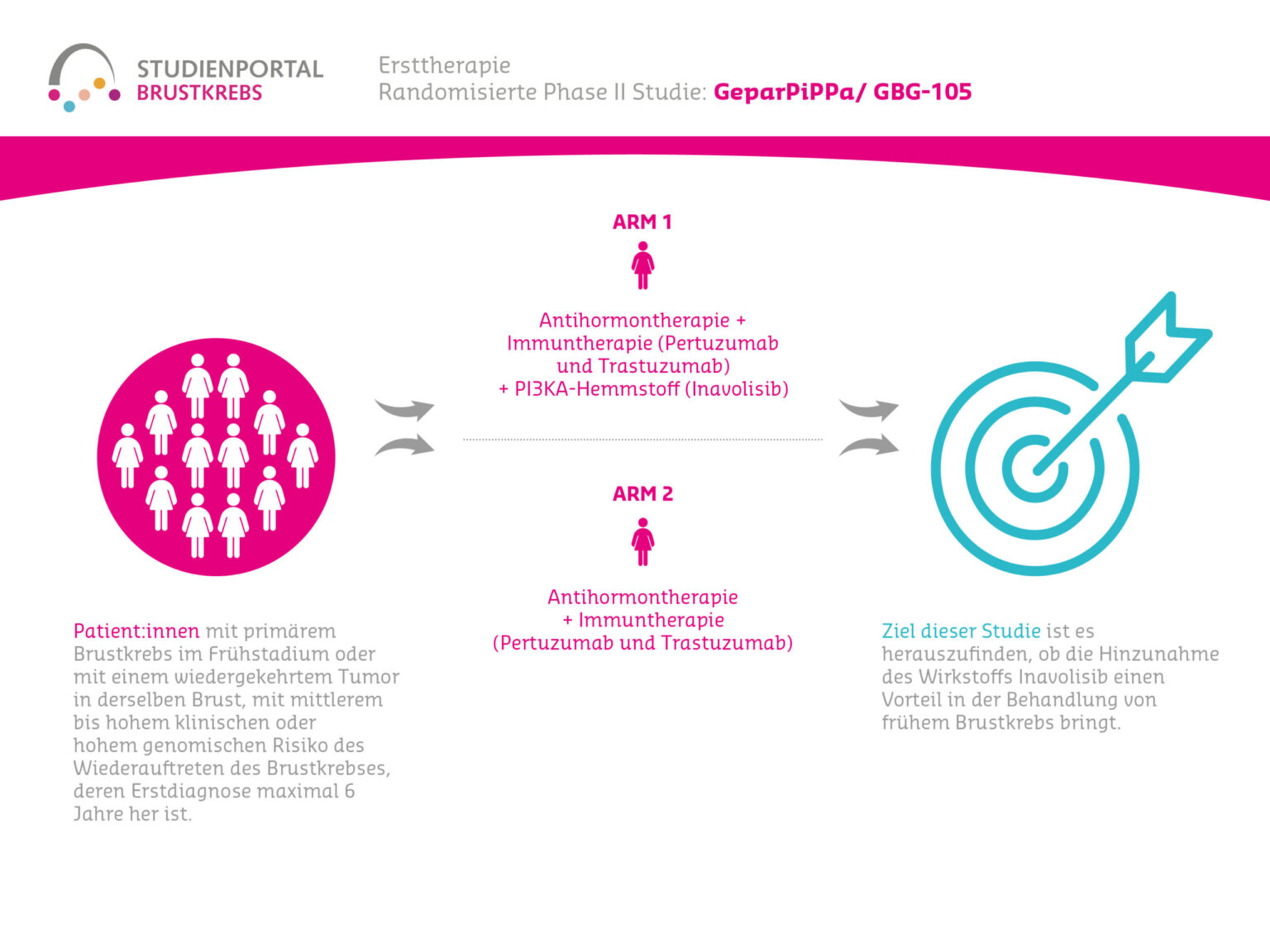
Die GeparPiPPa ist eine randomisierte (der Zufall entscheidet über die Behandlung der einzelnen Patient:in), nicht-verblindete (Arzt und Patient:in wissen, mit welchen Medikamenten behandelt wird) Phase-II-Studie zum Vergleich einer Antihormontherapie vor der Operation in Kombination mit den Immuntherapeutika Trastuzumab, Pertuzumab mit und ohne dem PIK3-Inhibitor Inavolisib bei Patient:innen mit HER2-positivem, HR-positivem, PIK3CA-mutiertem frühem (nicht metastasierten) Brustkrebs.
Was wird in dieser Studie untersucht?
Die Untersuchung des Rezeptorstatus ist ein zentraler Aspekt bei der Diagnose von Brustkrebs. Dieser Status liefert Informationen über die Präsenz bestimmter Moleküle in den Tumorzellen oder auf deren Oberfläche, die als potenzielle Ziele für medikamentöse Behandlungen dienen können. Eine dieser Molekülgruppen ist als “HER2” bekannt. „HER 2“ steht für “Humaner epidermaler Wachstumsfaktor-Rezeptor 2“. HER2 ist ein Rezeptor auf der Zelloberfläche von Tumoren, der das Zellwachstum stimuliert, wenn er aktiviert wird. 20-30 % aller Patientinnen mit einer hohen Anzahl an HER2 Rezeptoren (HER2 positiv) auf dem Tumor weisen eine Mutation auf dem Gen PIK3CA auf. Das Gen ist essenziell für die Herstellung des Enzyms PI3K, welches unter anderem wichtig ist für die Zellteilung. Tumore mit PIK3CA-Mutationen haben eventuell ein schlechteres Ansprechen auf eine Chemotherapie und Anti-HER2-Therapie. Dies gilt insbesondere bei Brustkrebs mit positiver Hormonrezeptorausbildung (HR+). Inavolisib ist ein oraler PI3KA-Hemmstoff, der vergleichbar ist mit anderen Arzneimitteln aus derselben Wirkstoffklasse, jedoch voraussichtlich ein besseres Wirksamkeits- und Verträglichkeitsprofil aufweist.
Was ist das Ziel der Studie?
Das primäre Ziel der Studie ist es die Wirksamkeit der Therapie mit Inavolisib zusammen mit zeitgleicher endokriner Therapie (Antihormontherapie), Pertuzumab und Trastuzumab zu vergleichen mit einer endokrinen Therapie mit Pertuzumab und Trastuzumab allein bei Patient:innen mit einem HER2-positivem, HR-positivem, PIK3CA-mutierten Brustkrebs im Frühstadium. Daneben soll außerdem die Sicherheit und Verträglichkeit der Behandlung, sowie die Therapietreue der Patient:innen untersucht werden.
Wie ist der Ablauf der Studie?
Brustkrebspatient:innen mit einer PIK3CA-Mutation werden im Verhältnis 1:1 zufällig einem der zwei Behandlungsarme zugeordnet und erhalten:
Arm A
Antihormontherapie vor der Operation, in Kombination mit einer Immuntherapie (doppelte Anti-HER2-Blockade, bestehend aus Pertuzumab und Trastuzumab als Injektion, welche unter die Haut verabreicht wird für 6 Zyklen (18 Wochen)), kombiniert mit Inavolisib in Tablettenform für 6 Zyklen (18 Wochen)
Arm B
Behandlungsschema gleich zu Arm A, nur ohne Inavolisib
Die Antihormontherapie besteht entweder aus Tamoxifen oder einem Aromatasehemmer (Medikament zur Hemmung der Östrogenproduktion), gegebenenfalls kombiniert mit einem GnRH-Analogon (Medikament zur Verhinderung des Eisprungs) für prämenopausale Frauen und für alle Männer. In beiden Studienarmen wird die Behandlung so lange fortgesetzt, bis eine Operation/Biopsie durchgeführt wird oder bei der Krankheit fortschreitende, inakzeptable Nebenwirkungen auftreten oder die Einwilligung zur Studie zurückgezogen wird.
Gibt es Risiken?
Über mögliche Risiken bzw. Nebenwirkungen, die mit der Teilnahme verbunden sind, werden Sie im Rahmen eines Aufklärungsgesprächs informiert.
Teilnahmevoraussetzungen
An dieser Studie können Männer und Frauen ab einem Alter von 18 Jahre teilnehmen, mit:
- Unbehandeltem primärem Brustkrebs (einseitig, keine Metastasen)
- Tumor in der Brust mit einem tastbaren Durchmesser von ≥ 2 cm oder einem Durchmesser von ≥ 1 cm im Ultraschall
- HER2-Rezeptor und Hormonrezeptor positiv
- Nachgewiesene PIK3CA Mutation des Tumors
Darüber hinaus gibt es aber auch noch weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patientinnen sollten mit den Prüfärzt:innen an einem Studienzentrum sprechen, welche prüfen können, ob diese Studie für sie in Frage kommt.
Weitere Studien der GBG-Studiengruppe finden Sie hier.