DESTINY-Breast05 / GBG-103
Immuntherapie mit Antikörper-Wirkstoff-Verbindungen bei Hochrisikopatienten mit frühem, HERZ2-positivem Brustkrebs und Tumorrest nach abgeschlossener Chemotherapie, Antikörperbehandlung und Operation
Die Rekrutierung der Studie wurde im März 2024 abgeschlossen.
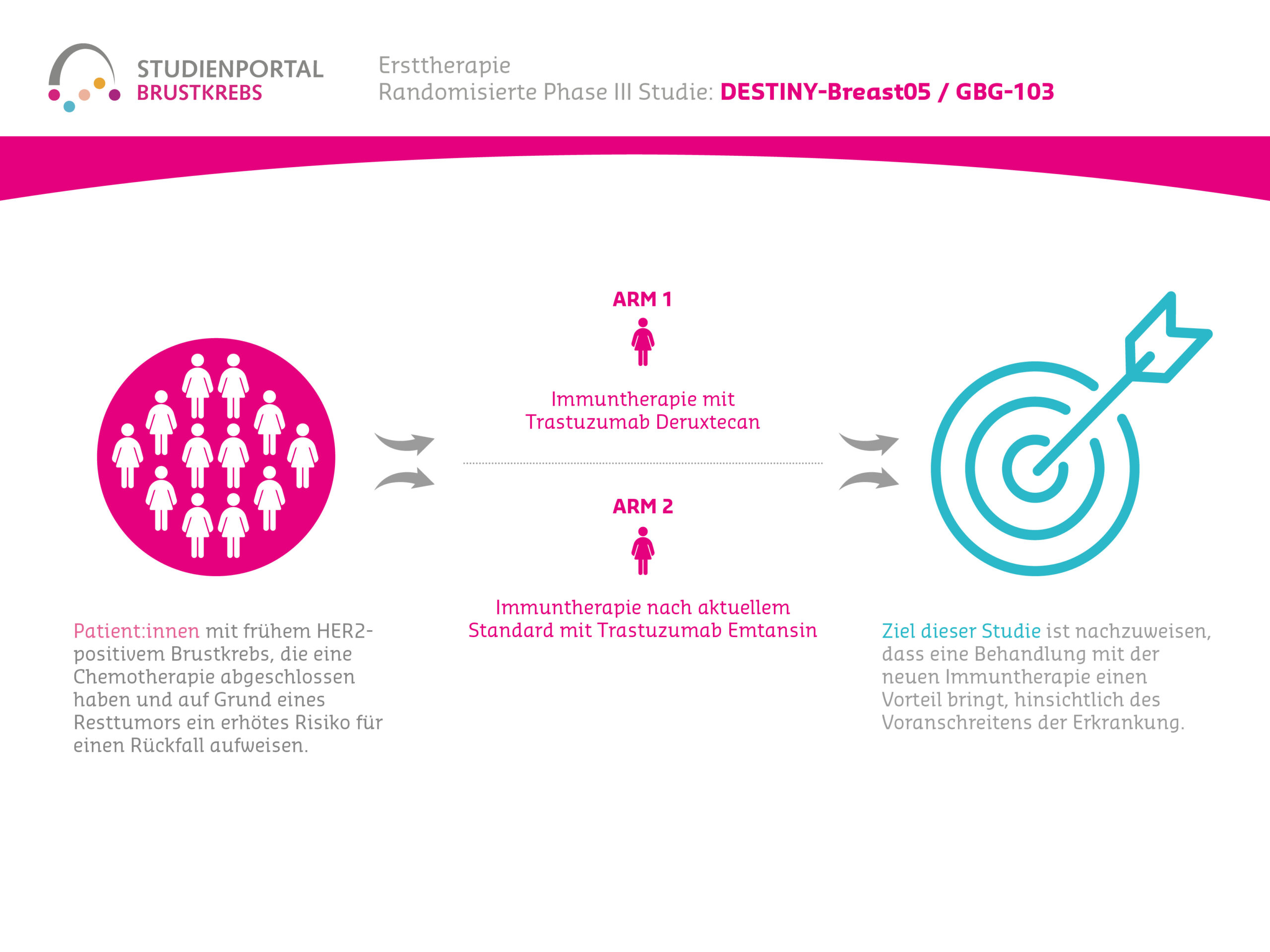
Die DESTINY-Breast05 ist eine randomisierte (die Zuordnung der Behandlung für die konkrete Patientin erfolgt per Zufall), kontrollierte, Phase-3 Therapiestudie, in der zwei Immuntherapien gegeneinander verglichen werden bei Patient:innen mit HER2-positivem, frühem (Patientin hat keine Metastasen mit Ausnahme von Lymphknotenmetastasen in der Achsel) Brustkrebs. Bei diesen Patient:innen sind die Chemotherapie + Anti-HER2-Therapie (Antikörpergabe, also eine Form der Immuntherapie) vor der Operation und die Operation bereits durchgeführt worden. Aufgrund eines Resttumors in der Brust oder den Lymphknoten in den Achseln haben diese Patient:innen ein hohes Risiko eines Krankheitsrückfalls.
Was wird in dieser Studie untersucht?
Eine vorherige Studie (KATHERINE) mit einem Antikörper-Wirkstoff-Konjugat (AWK, Trastuzumab Emtansin, T-DM1) verlief positiv und bestätigte den Nutzen von AWKs für Patient:innen nach abgeschlossener Chemotherapie mit Antikörpergabe vor der Operation (Neoadjuvante Behandlung) und nachgewiesenem Tumorgeweberest nach dieser Behandlung und Operation. Ein Antikörper-Wirkstoff-Konjugat ist eine Verbindung aus einem Arzneistoff, der an einen Antikörper gebunden ist. Die meisten Antikörper-Wirkstoff-Konjugate sind Chemoimmunkonjugate, das bedeutet, dass an den Antikörpern ein Arzneistoff geknüpft ist, welcher zellschädigend wirkt. In diesem Fall spricht man auch von bewaffneten Antikörpern. AWKs binden speziell an Tumorzellen und setzen dann das Arzneimittel frei, sodass das Wachstum des Tumors gestört werden kann.
Trotz der Tatsache, dass die KATHERINE-Studie positiv war, besteht in dieser Patientengruppe ein weiterer bisher ungedeckter medizinischer Bedarf, da nicht alle Patient:innen mit der bisherigen Behandlung geheilt werden konnten. Deswegen ist die DESTINY-Breast05 Studie geplant für Patient:innen, die nach abgeschlossener neoadjuvanter Therapie (Chemotherapie + HER2-gerichtete Therapie, Trastuzumab) operiert wurden und bei denen trotz der Behandlung ein Resttumor nachgewiesen wurde (in der Brust oder den Lymphknoten in den Achseln). Es soll untersucht werden, ob der AWK Trastuzumab Deruxtecan (T-DXd) in seiner Wirksamkeit besser ist als der AWK Trastuzumab Emtansin (T-DM1) bei diesen Patientinnen. Die Behandlung mit T-DM1 ist aktuell der Behandlungsstandard und dient in dieser Studie als Kontrolle.
Was ist das Ziel der Studie?
Das primäre Ziel dieser Studie ist es nachzuweisen, dass eine Behandlung mit Trastuzumab Deruxtecan einen Vorteil hinsichtlich des Voranschreitens oder der Wiederkehr des Brustkrebses hat, im Vergleich zu Trastuzumab Emtansin bei HER2-positiven Patient:innen, die nach einer abgeschlossenen Chemotherapie und anschließender Operation einen Resttumor aufweisen. Außerdem soll untersucht werden, ob es einen Zusammenhang zwischen dem individuellen Biomarker-Status des Tumors (HER2 und Hormonrezeptor-Status) und der Wirksamkeit und/oder Sicherheit der Behandlung gibt.
Wie ist der Ablauf der Studie?
Im Rahmen der Studie gibt es zwei Behandlungsarme, denen die Patient:innen in einem Verhältnis von 1:1 zufällig zugeordnet werden:
Arm 1:
Trastuzumab Deruxtecan – intravenöse Injektion alle 3 Wochen für ca. 12 Monate
Arm 2:
Trastuzumab Emtansin – intravenöse Injektion alle 3 Wochen für ca. 12 Monate
Gibt es Risiken?
Über mögliche Risiken bzw. Nebenwirkungen, die mit der Teilnahme verbunden sind, werden Sie im Rahmen eines Aufklärungsgesprächs informiert.
Teilnahmevoraussetzungen
An dieser Studie können Männer und Frauen ab einem Alter von 18 Jahre teilnehmen, mit:
- Ersterkrankung an Brustkrebs, ohne Metastasen mit Ausnahme von Lymphknotenmetastasen in der Achselhöhle
- HER2-Rezeptor positiver Tumor
- Nachgewiesener Resttumor in Brust oder Lymphknoten der Achselhöhlen
- Zuvor abgeschlossene neoadjuvante Chemotherapie und Immuntherapie (Antikörpertherapie) einschließlich von Trastuzumab (Anti-HER2-Therapie)
Darüber hinaus gibt es aber auch noch weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patientinnen sollten mit den Prüfärzt:innen an einem Studienzentrum sprechen, welche prüfen können, ob diese Studie für sie in Frage kommt.
Weitere Studien der GBG-Studiengruppe finden Sie hier.
