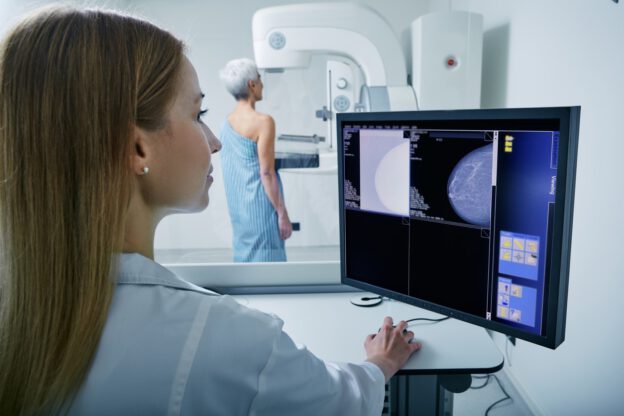
Die TROPION-Breast04 ist eine randomisierte (die Zuordnung der Behandlung für die konkrete Patientin erfolgt per Zufall), kontrollierte, Phase-3 Therapiestudie. In der Studie wird eine neue Therapie gegen die aktuelle Standardbehandlung verglichen und sie richtet sich an Patient:innen mit dreifach negativem (oder Hormonrezeptor-low, „HR-low“/ HER2-negativ), frühem (Stadium II oder III) Brustkrebs. Zudem wurde bei diesen Patient:innen bisher noch keine Behandlung durchgeführt (behandlungsnaiv).
Was wird in dieser Studie untersucht?
Datopotamab deruxtecan (Dato-DXd) ist ein Medikament, das aus zwei Teilen besteht: Datopotamab (ein Antikörper) und deruxtecan (ein Krebsmedikament), die miteinander verbunden sind. Datopotamab bindet an ein Protein namens Trophoblast-Zelloberflächenantigen 2 (TROP2), das auf TNBC-Tumoren gefunden wird. TNBC steht für „triple negative breast cancer“, also dreifach negativer Brustkrebs. Das bedeutet, dass die Brustkrebszellen keine Rezeptoren (Eiweißverbindungen am Zellkern oder auf der Zellmembran) für Östrogen, Progesteron und HER2 haben. Einmal gebunden, wird Dato-DXd in die Tumorzelle aufgenommen, wo das Deruxtecan freigesetzt wird, um den Tumor zu töten. Durvalumab ist ein Medikament, das die Aktivität eines Eiweißes namens PD-L1 blockiert, wodurch Tumoren anfälliger für die Tötung durch die körpereigenen Immunzellen werden.
In vorangegangenen Studien mit Patient:innen mit einem TNBC, die mit Dato-DXd allein (TROPION-PanTumor01) oder in Kombination mit Durvalumab (BEGONIA-Studie) behandelt wurden, wurde eine Wirksamkeit gegen Brustkrebs festgestellt.
Was ist das Ziel der Studie?
Die Studie richtet sich an Patient:innen mit dreifach negativem Brustkrebs (TNBC), eine Art von Brustkrebs, bei dem die Zellen keine HER2-, Östrogen- oder Progesteronrezeptoren haben. Die aktuelle Standardbehandlung für Patientinnen mit einem TNBC ist die anfängliche Behandlung mit Pembrolizumab, kombiniert mit einer Chemotherapie, gefolgt von der Entfernung des Tumors und von Lymphknoten aus der Achselhöhle. Pembrolizumab wird nach der Operation für insgesamt ein Jahr weitergegeben. Mit dieser sehr wirksamen Tumorbehandlung werden dennoch nicht alle Patient:innen geheilt. Deshalb muss diese Behandlung verbessert werden, damit möglichst mehr Patient:innen mit einem TNBC geheilt werden können.
In der TROPION-Breast04-Studie soll deswegen untersucht werden, ob Dato-DXd kombiniert mit Durvalumab gefolgt von einer Operation und der Weitergabe von Durvalumab besser wirken als die aktuelle Standardbehandlung für diese Patient:innen. Die Studie wird bewerten, wie gut Dato-DXd plus Durvalumab wirkt und die Nebenwirkungen beschreiben.
Wie ist der Ablauf der Studie?
Im Rahmen der Studie gibt es zwei Behandlungsarme (Behandlungsmöglichkeiten), denen die Patient:innen in einem Verhältnis von 1:1 zufällig zugeordnet werden:
Arm 1:
Vor der Operation (neoadjuvant):
Datopotamab deruxtecan zusammen mit Durvalumab als intravenöse Infusion alle 3 Wochen für 8 Zyklen (Infusionen)
Nach der Operation (adjuvant):
Durvalumab als intravenöse Injektion alle 3 Wochen für 9 Zyklen
Arm 2:
Vor der Operation (neoadjuvant):
Pembrolizumab als intravenöse Infusion alle 3 Wochen zusammen mit Carboplatin und Paclitaxel für 4 Zyklen. Anschließend Pembrolizumab und Cyclophosphamid und Doxorubicin oder Epirubicin als intravenöse Infusion alle 3 Wochen für 4 Zyklen
Nach der Operation (adjuvant):
Pembrolizumab als intravenöse Infusion alle 3 Wochen für 9 Zyklen
Gibt es Risiken?
Über mögliche Risiken bzw. Nebenwirkungen, die mit der Teilnahme verbunden sind, werden Sie im Rahmen eines Aufklärungsgesprächs informiert.
Teilnahmevoraussetzungen
An dieser Studie können Männer und Frauen ab einem Alter von 18 Jahre teilnehmen, mit:
- Dreifach negativem oder HR-low & HER2-negativem Brustkrebs ohne Metastasen
- Stadium II-III
- Kein Hinweis auf Fernmetastasen
- Bisher unbehandelt (noch keine Therapie gestartet, z. B. Operation, Radiotherapie, systemische Therapie, Immuntherapie, etc.)
Darüber hinaus gibt es aber auch noch weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patient:innen sollten mit den Prüfärzt:innen an einem Studienzentrum sprechen, welche prüfen können, ob diese Studie für sie in Frage kommt.
Wo kann ich an dieser Studie teilnehmen?
Weitere Informationen zu teilnehmende Zentren finden Sie hier:
https://studienportal-brustkrebs.de/deutschlandkarte
Diese Studie wird unterstützt von: