Ende Juni fand das 26. NOGGO-Update zur gynäkologischen Onkologie statt, bei dem wichtige Studien zum Brustkrebs von der ASCO 2025 vorgestellt wurden. Wir waren vor Ort und möchten die wichtigsten Erkenntnisse teilen:
1. Neue molekulare Therapieansätze bei fortgeschrittenem Brustkrebs
Hier eine Übersicht zu aktuellen Studien, die innovative molekulare Therapien bei hormonabhängigem Brustkrebs untersuchen:
1️⃣ PF‑07248144: Neuer KAT6-Inhibitor als Option bei endokriner Resistenz
In einer Phase-1-Studie wurde PF‑07248144, ein neuartiger KAT6-Inhibitor, in Kombination mit Fulvestrant bei Patientinnen mit Östrogenrezeptor‑positivem, HER2-negativem metastasiertem Brustkrebs getestet. Bei täglich 5 mg PF‑07248144 plus Fulvestrant zeigte sich eine Ansprechrate von etwa 37 % und ein durchschnittliches Überleben ohne Fortschreiten der Krankheit von 10,7 Monaten . Die Verträglichkeit war insgesamt akzeptabel. Da KAT6 in vielen Fällen mit endokriner Resistenz (= Situation, in der Brustkrebszellen nicht mehr auf Hormontherapie reagieren) zusammenhängt, könnte dieser Wirkstoff künftig zur Therapieoption werden, sobald Phase‑III-Daten folgen.
Ein KAT6-Inhibitor ist ein Wirkstoff, der gezielt das Protein KAT6 blockiert. Dieses Protein beeinflusst bestimmte Gene (z. B. die der Östrogenrezeptoren) und verändert somit deren Aktivität. So kann die Tumorzellaktivität unterdrückt und die Hormontherapie ergänzt werden.
2️⃣ Vepdegestrant: PROTAC-basierter Östrogenrezeptor-Abbau
Die Phase‑III-Studie VERITAC-2 verglich Vepdegestrant, einen neuartigen PROTAC-ER-Degrader, mit Fulvestrant bei Östrogenrezeptor-positivem, HER2-negativem Brustkrebs mit ESR1-Mutation. In dieser Subgruppe war das progressionsfreie Überleben signifikant verlängert (Median 5,0 vs. 2,1 Monate) . Die Gesamtpopulation zeigte allerdings keinen eindeutigen Vorteil, daher bleiben weitere Daten abzuwarten.
Ein PROTAC-ER-Degrader ist eine neue Art von Medikament, das gezielt den Östrogenrezeptor (ER) in Tumorzellen zerstört – indem es den natürlichen Proteinentsorgungsweg der Zelle nutzt.
ESR1 ist ein Gen, welches die Informationen zum Bau des Östrogenrezeptor α (ERα) enthält. Dieser Rezeptor reagiert auf das Hormon Östrogen und dessen Signal führt zum Zellwachstum.
3️⃣ Ipatasertib + Fulvestrant: AKT-Inhibition zeigt Wirkung
Die FINER-Studie untersuchte bei Östrogenrezeptor-positiven, HER2-negativen Patientinnen die Kombination Ipatasertib mit Fulvestrant nach Therapieversagen unter CDK4/6-Inhibitor plus Aromatasehemmer. Das durchschnittliche Überleben ohne Krankheitsfortschritt betrug 5,3 Monate gegenüber 1,9 Monaten im Kontrollarm. Besonders Patientinnen mit Veränderungen im AKT-Signalweg (= zentrale zelluläre Steuerungskaskade, die das Wachstum, die Überlebensfähigkeit und den Stoffwechsel von Zellen regelt) profitierten stärker (5,5 vs 1,9 Monate). Die Verträglichkeit war moderat, Abbruchraten wurden bislang aber nicht berichtet.
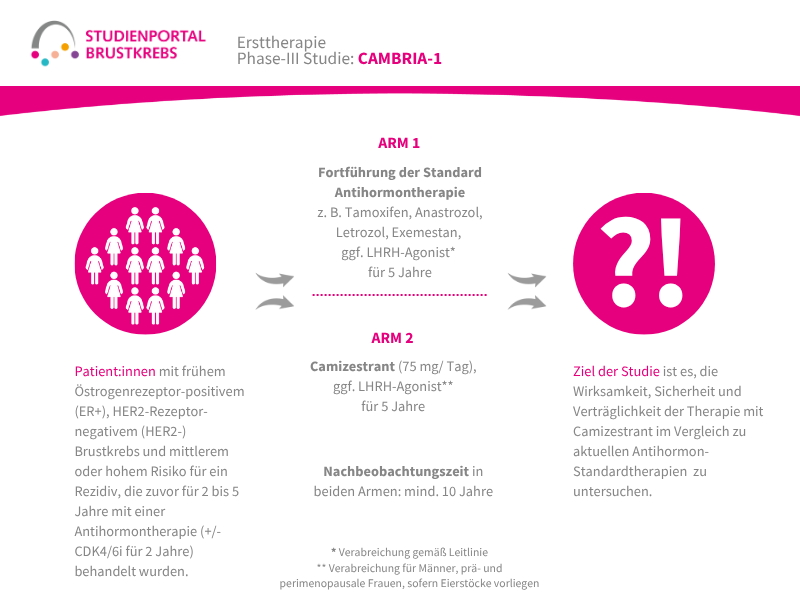
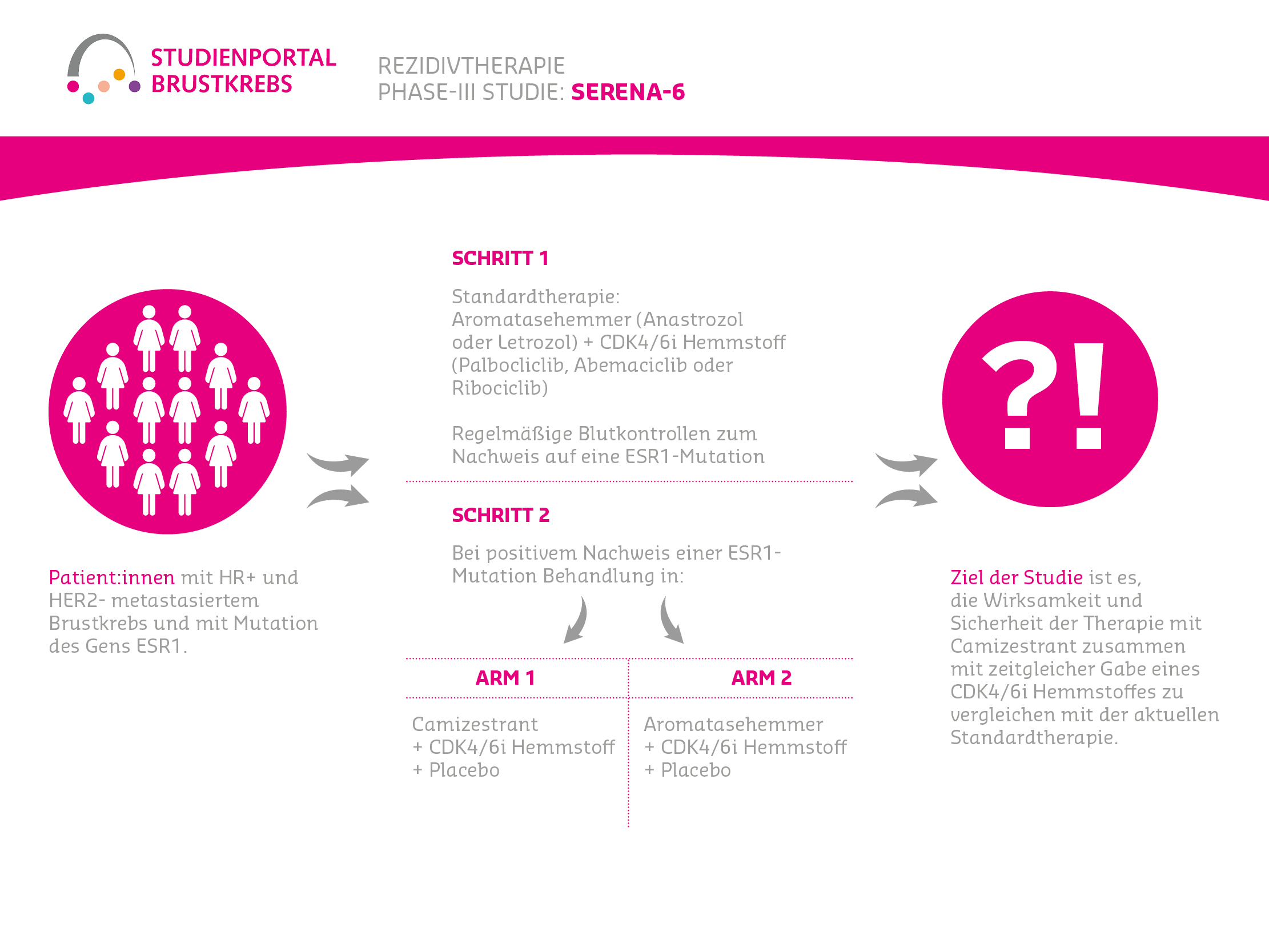
4️⃣ SERENA‑6: Paradigmenwechsel mit Liquid Biopsy und Camizestrant
Die SERENA-6-Studie zeigt einen neuen Ansatz: Patientinnen mit einer ESR1-Mutation, erkannt durch regelmäßiges Testen der zirkulierenden Tumor-DNA (ctDNA-Tests), wechselten frühzeitig auf Camizestrant, was das Fortschreiten des Tumors um etwa 56 % verringerte (Median PFS etwa 16 statt 9 Monate). Auch wurde eine günstigere Lebensqualität beobachtet. Der Clou: Die Therapieumstellung erfolgt bevor radiologisch oder symptomatisch ein Rückfall sichtbar ist – ein echter Schritt hin zur individualisierten, Biomarker-gesteuerten Behandlung. Jedoch bleibt noch die Frage offen an welchen Zeitpunkten und wie oft optimal getestet werden sollte.
Fazit für die Klinik und Patientinnen
Diese Studien zeigen vielversprechende Fortschritte in der molekular gesteuerten Therapie bei hormonabhängigem Brustkrebs. Besonders die Ansätze mit KAT6-Inhibitoren, PROTAC-Degradern sowie die biomarkerbasierte Steuerung via ctDNA markieren den Beginn einer neuen Therapieära.
Allerdings gilt weiterhin: Für die meisten Bereiche gibt es keine Leitlinienänderungen – erst Phase‑III- oder Langzeitdaten können neue Standards begründen.
2. Aktuelle Erkenntnisse zur Hormontherapie beim frühen Brustkrebs
Die Kombination aus Ovarialfunktionsunterdrückung (OFS) und Hormontherapie wurde in mehreren großen Studien mit prämenopausalen Patientinnen genau untersucht.
- In den SOFT- und TEXT-Studien wurde der Nutzen von Exemestane plus OFS versus Tamoxifen plus OFS über mehr als zehn Jahre verfolgt. Dabei verbesserte sich das krankheitsfreie Überleben nach zwölf Jahren um etwa 4,6 %. Das Gesamtüberleben war in der Gruppe mit niedrig eingestuftem Rückfallrisiko fast gleich – aber bei Frauen mit höherem Rückfallrisiko konnte mit Exemestane plus OFS ein Überlebensvorteil von bis zu 5,5 % erzielt werden.
-
Die koreanische ASTRRA-Studie verglich Tamoxifen alleine mit Tamoxifen kombiniert mit OFS bei Frauen jünger als 45 Jahre, die noch Zyklen hatten. Die Ergebnisse zeigten einen klaren Rückfallverzicht über fünf Jahre bei den Frauen mit zusätzlicher OFS – besonders relevant bei vorheriger Chemotherapie.
-
Bei jungen Frauen mit BRCA-Mutation wurde gezeigt, dass die Kombination aus OFS mit Aromatasehemmer bei hohem Rückfallrisiko die besten Überlebenschancen bietet – während bei niedrigem Risiko Tamoxifen alleine ausreichend sein kann.
-
Außerdem wurde im Rahmen der Phase III-Studie OASIS‑4 der Wirkstoff Elinzanetant getestet: Er kann Hitzewallungen („Hot Flashes“) und Schlafstörungen lindern, die durch die Hormontherapie verursacht werden. Bereits nach wenigen Wochen wurde eine Reduktion dieser Symptome um mehr als 50 % erreicht – bei guter Verträglichkeit – und damit eine klare Verbesserung der Lebensqualität.
Fazit: Was heißt das für Patientinnen?
Bei niedrigem Risiko: Patientinnen können gut mit Tamoxifen allein behandelt werden – oft ausreichend und mit weniger Nebenwirkungen.
Mittleres Risiko: Eine Entscheidung zwischen Tamoxifen alleine oder Tamoxifen/Aromatasehemmer plus OFS ist möglich. Die Nebenwirkungsprobleme sollten berücksichtigt werden.
Bei hohem Risiko: Für Patientinnen mit hohem Rückfallrisiko scheint Exemestane plus OFS derzeit die wirksamste Option.
Zudem zeigt die Entwicklung neuer Medikamente wie Elinzanetant: Nebenwirkungsmanagement wird zunehmend wichtiger, damit Patientinnen Hormontherapien langfristig durchhalten.
3. Aktuelle Therapieansätze beim metastasierten Brustkrebs
1️⃣ HR+ HER2- Brustkrebs: Inavolisib plus Palbociclib & Fulvestrant
Die INAVO120-Studie zeigte bei Patientinnen mit hormonrezeptor-positivem (HR+), HER2-negativem, metastasiertem Brustkrebs mit PIK3CA-Mutation – und rascher Progression während oder innerhalb eines Jahres nach adjuvanter Hormontherapie – den größten Therapieerfolg. Die Kombination aus Inavolisib, Palbociclib und Fulvestrant verdoppelte das Überleben ohne Krankheitsfortschritt und verlängerte das Gesamtüberleben um etwa sieben Monate (34 vs. 27 Monate) im Vergleich zur Standardtherapie .
Wichtig: Ein PIK3CA-Test vor der Erstlinientherapie ist deshalb jetzt entscheidend. Zusätzlich ist ein proaktives Nebenwirkungsmanagement notwendig, da etwa Mundschleimhautentzündungen (Stomatitis) und Durchfälle auftreten können.
PIK3CA ist ein Gen, das die Bauanleitung für ein Enzym liefert, welches eine wichtige Rolle im PI3K/AKT-Signalweg spielt. Dieser Weg steuert das Zellwachstum, Überleben und die Teilung.
2️⃣ Triple-negativer Brustkrebs (TNBC): Sacituzumab Govitecan + Pembrolizumab
In der internationalen ASCENT‑04/KEYNOTE‑D19-Studie verbesserte die Kombination aus Antikörper-Wirkstoff-Konjugat Sacituzumab Govitecan und Pembrolizumab deutlich das Überleben ohne Krankheitsfortschritt (Median 11,2 vs. 7,8 Monate) bei PD-L1-positivem, metastasiertem TNBC. Die Gesamtüberlebensdaten sind noch nicht vollständig, aber erste Trends deuten auf einen Vorteil hin. Sicherheitsprofil und Verträglichkeit entsprachen den bekannten Eigenschaften, ohne neue Risiken. Eine Zulassungserweiterung für die Anwendung in der Erstlinie steht noch aus.
3️⃣ HER2-positiver metastasierter Brustkrebs: T‑DxD (Trastuzumab Deruxtecan) + Pertuzumab
Die Phase‑III-Studie DESTINY‑Breast09 zeigte, dass die Kombination aus T‑DxD und Pertuzumab das Überleben ohne Krankheitsfortschritt im Vergleich zur bisherigen Standardtherapie (Paclitaxel + Trastuzumab + Pertuzumab) bei HER2-positivem Brustkrebs deutlich verlängert (Median 40,7 vs. 26,9 Monate). T‑DxD hat damit das Potenzial, künftig die neue Erstlinientherapie zu werden. Die Zulassungserweiterung und Daten zur Wirksamkeit von T‑DxD als Monotherapie sind noch offen.
Fazit für Patientinnen & Kliniken
Diese neuen Therapiekombinationen zeigen enorme Fortschritte in der gezielten Behandlung des metastasierten Brustkrebses:
-
Inavolisib + Palbociclib + Fulvestrant bietet Patientinnen mit PIK3CA-mutiertem HR+, HER2- Brustkrebs einen signifikanten Überlebensvorteil – PIK3CA-Testung vor Start ist essentiell.
-
Sacituzumab Govitecan + Pembrolizumab könnte eine vielversprechende neue Option für PD-L1-positive TNBC-Patientinnen sein – sofern die Zulassung erfolgt.
-
T‑DxD + Pertuzumab zeigte herausragende Wirksamkeit bei HER2+ Brustkrebs und könnte bald den bisherigen Standard ablösen.
Aktuell gibt es jedoch auch hier noch keine offiziellen Leitlinienänderungen. Diese Daten markieren aber einen wichtigen Schritt zu noch wirksameren und zielgerichteteren Therapien beim metastasierten Brustkrebs.